Steinar Skrede, seksjonsoverlege infeksjonsmedisinsk seksjon, Medisinsk avdeling, Haukeland universitetssykehus, 1.amanuensis Klinisk institutt 2, Universitetet i Bergen.
Hans K. Flaatten, overlege Intensivmedisinsk seksjon, Kirurgisk serviceklinikk, Haukeland universitetssykehus, professor Klinisk institutt 1, Universitet i Bergen.

Steinar Skrede og Hans K. Flaatten.
I februar 2016 ble det publisert nye internasjonale konsensusdefinisjoner for sepsis og septisk sjokk.
Endringene som beskrives er omfattende. Sepsis skal forstås som syndrom, med ulike faser og ulike biologiske forløp avhengig av en rekke faktorer, ikke som et kontinuum av reaksjoner med enhetlig forløp. Det anbefales at bruk av SIRS kriteria forlates, og at man screener pasienter ved et enkelt verktøy for å identifisere organdysfunksjon kalt quickSOFA. Det må organdysfunksjon til for at man skal kategorisere pasienter med sepsis. Enhetlig bruk av SOFA score som verktøy i identifikasjon av organsvikt anbefales. Alvorlig sepsis utgår som enhet, mens sepsis benyttes for pasienter som tidligere tilhørte denne kategorien, det vil si pasienter med infeksjon og organsvikt.
Etter 25 år med anvendte kriterier for sepsis (1), som ble utvidet i 2003 (2), startet prosesser langs ulike akser for å komme videre med definisjonene. I 2014 etablerte den europeiske (ESICM) og den amerikanske (SCCM) intensivforeningen en uavhengig, tverrfaglig ekspertgruppe på 19 personer som fikk i oppdrag å utarbeide et nytt rammeverk rundt sepsis og foreslå oppdateringer av definisjoner av sepsis og septisk sjokk. Arbeidet inkluderte også en gjennomgang av pasientregistre og ulike sepsiskohorter. Gruppen kom frem til en anbefaling som fikk tilslutning etter høringsrunder i 31 fagorganisasjoner rundt om i hele verden. Under den amerikanske intensivkongressen i februar 2016 ble så detaljene offentliggjort og nye definisjoner ble presentert i JAMA den 23. februar i år (3).
Konsensusgruppen har utarbeidet definisjoner og kliniske kriteria til bruk ved sepsis og septisk sjokk.

Figur 1. Med sepsis forstås infeksjon der organdysfunksjon i alle grader knyttes til selve definisjon av sepsis. Med dette valget har begrepet alvorlig sepsis utgått. Begrepet septisk sjokk er beholdt og beskriver en mindre gruppe spesielt dårlige pasienter med sepsis med > 40% dødelighet i sykehus.
Med sepsis som sykdomskonsept forstås infeksjon der en ubalansert vertsrepons fører til livstruende organdysfunksjon (Figur 1).
Det som da skiller sepsis fra infeksjon er denne dysregulerte vertsreaksjonen og utvikling av organdysfunksjon.
Det nye kliniske verktøyet til å kategorisere organdysfunksjon er scoringssystemet Sequential (sepsis related) organ failure assessment (SOFA). Grensen for organsvikt defineres som økning i SOFA-score på to poeng eller mer. Hos pasienter med sepsis er den beregnete risikoen for død under sykehusoppholdet > 10 %.
Med septisk sjokk forstår man en subgruppe av pasienter med sepsis som har alvorlig sirkulasjonssvikt og avvik i cellulære responser og i metabolisme.
Den kliniske kategoriseringen tar utgangspunkt i behov for vasopressor for å opprettholde middelarterietrykk >65 mm Hg og der serum-laktat konsentrasjonen er > 2 mmol/l hos pasienter som ikke er hypovoleme.
Pasienter med septisk sjokk har beregnet risiko for død i sykehus > 40 %.
Til bruk utenfor sykehus, i mottaksavdelinger og i ordinære sengeposter kan voksne med mistenkt sepsis raskt risikovurderes ved bruk av en forenklet versjon av SOFA score. Den forenklete versjonen har fått navnet quick-SOFA (qSOFA, tabell 1). Ulikt full SOFA score, er denne uavhengig av klinisk biokjemiske prøvesvar for identifikasjonen av pasienter. qSOFA defineres som tilstedeværelse av minst to av de følgende kjennetegnene:
Konsensuskonferansen går ikke inn på hvordan en skal definere en infeksjon, men det er en premiss for bruk av definisjonene at infeksjonsårsak er sannsynlig. Ved sepsis kan organdysfunksjon være ukjent, og må ofte aktivt avdekkes hos pasienter som har infeksjoner. Omvendt har mange med organdysfunksjon infeksjon. Dette må man lete etter klinisk, når årsaken til organsvikten ikke er kjent.
Identifisering av pasienter med sepsis blir inndelt i to:
I første gruppe foreslås bruk av en systematisk evaluering av et organ-sviktskår: SOFA-score (tabell 2).
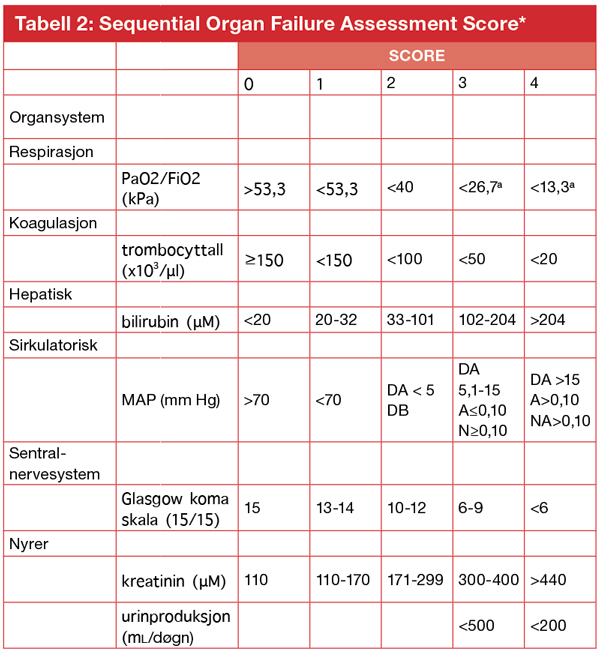
*adaptert fra (4) slik den er presentert i (3). Forkortelser: PaO2 arterielt partialtrykk surstoff, FiO2 fraksjon inspirert surstoff, MAP middelarterietrykk, DA dopamin, DB dobutamin, A adrenalin, NA noradrenalin. For alle katekolaminer angis dosering i μg/kg/minutt i ≥ 60 minutter. For DB enhver dose. aMed ventilasjonsstøtte.
Denne organsviktevalueringen ble utviklet i 1996 (4), og skårer ulike grader av organdysfunksjon i seks vitale organsystem. SOFA ble i forbindelse med revisjon av kriteriene retrospektivt testet i en stor populasjon med bekreftet infeksjon og funnet å fungere godt for å identifisere organsvikt ved infeksjoner, altså sepsis. Det foreslås at en endring på 2 poeng eller mer skal kunne identifisere en ny eller økende organdysfunksjon. Det foreslås videre at pasienter der det ikke er kjent å foreligge etablert organsvikt fra før skal ha score 0.
Bruk av full SOFA score forutsetter bruk av klinisk kjemiske biomarkører og Glasgow Coma Scale (GCS), som er gjengitt i lokalt tilpasset form i tabell 3. GCS er vanlig i bruk i Norge ved håndtering av pasienter med akutt innsett-ende bevissthetsreduksjon.
Oppdragsgiverne til arbeidet med nye konsensusdefinisjoner har begrunnet behovet for en oppdatering med manglene ved tidligere definisjoner.
En av de viktigste årsakene har vært at de gamle sepsisdefinisjonene har hatt overdrevent fokus på inflammasjon. Videre har man begrunnet behovet med at den tidligere sepsisdefinisjonen har vektlagt at sepsis patofysiologisk er en reaksjon der sepsis i forverring utvikler i et biologisk kontinuum gjennom alvorlig sepsis til septisk sjokk (5). Denne biologiske forklaringsmodellen er siden den gang forlatt, og det er avdekket et behov for å etablere en definisjon og en forståelse av «selve tilstanden», i erkjennelse av at sepsis ikke en tilstand i seg selv. Sepsis er et «syndrom», det har ulike faser og ulike biologiske forløp, som avhenger av medfødte og utviklete vertsfaktorer (kirurgi, medikamentell behandling mm), så vel som mikrobefaktorer.
I tidlig fase aktiveres pro- og anti-inflammatoriske reaksjonsveier, slik det er belyst i en av de øvrige artiklene i dette temanummeret. Et annet argument, har vært, ikke å bruke de sterkt kritiserte målene på systemisk inflammatorisk respons (SIRS). Leukocytter, kroppstemperatur og hjertefrekvens er ikke gode mål for en vertsrespons på infeksjon som er i ubalanse. En betydelig andel av pasienter som har vært screenet for inklusjon i en rekke sepsisstudier har ikke hatt alvorlig infeksjon, men fylt 2 eller mer av 4 SIRS-kriterier. Å fylle SIRS-kriteria når man har infeksjon betyr heller ikke automatisk at responsen som oppstår er ukontrollert. I Australia og New Zealand har man gjennom 14 år identifisert sepsispasienter gjennom vurderinger av mer enn 90 % av oppholdene i intensivavdelingene. I denne kohorten hadde 1/8 av de voksne pasientene ikke oppfylt noe SIRS-kriterium (6). Pasientgrunnlaget i denne er så stort som 110.000 pasienter.
I tillegg til at SIRS har vært lite sensitive og spesifikke mål, har vi en opplevelse av at bruk av SIRS til kategorisering, har ført til svekket søken etter primærfokus der de har vært oppfylt. Videre har vi opplevd det som potensielt ugunstig at SIRS kriteria kan være fraværende selv hos pasienter med infeksjon og fare for ugusntig forløp.
Med nye definisjoner har man søkt å utvikle kriterier som inkluderer alle karaktertrekkene ved sepsis; infeksjon (ikke definert, men en premiss), vertsrespons og organdysfunksjon (målt som respirasjonsrate, Glasgow Coma Scale score og systolisk blodtrykk). Man har ønsket at kriteriene skal være enkle, billige og tilgjengelige uten forsinkelse. Et av målene med dette er at behandlingstiltakene kan settes i verk raskt. Videre har man ønsket målenheter som er testbare, til bruk både i og utenfor enheter der ressursene til å håndtere alvorlig infeksjon er svært store. Bruk av qSOFA sammenlignet mot SOFA eller infeksjon + SIRS er vurdert og utgjør grunnlagsdata i konsensusgruppen sitt arbeid (2). Med nye definisjoner har man ønsket å stimulere enhetlig bruk av kriterier for organsvikt. Ved entydig å anbefale bruk av SOFA-score, vil man overkomme vanskene studier av «alvorlig sepsis» og septisk sjokk har hatt, ved at det har vært benyttet flere forskjellige definisjoner av organsvikt. Dette vil gjøre fremtidige studier mer enhetlige i fremstillingen av en ellers heterogen pasientpopulasjon. Det er gjennomført en rekke studier der behandlingsutfall har vært sterkt påvirket av hvilke definisjoner og kliniske verktøy man har brukt i kategoriseringen. Ved å anbefale identifikasjon av pasienter med risiko for alvorlig forløp ved bruk av scoringssystemet qSOFA, som er fritt for biokjemiske parametere, har man også tatt konsekvensen av det ikke finnes etablerte biomarkører med høy sensitivitet og spesifisitet til bruk i den kliniske hverdagen. Den gamle kategorien sepsis, infeksjon og to av fire SIRS kriterier, er forlatt. Sepsis i dag er avgrenset til det som før het «alvorlig sepsis»; sepsis med organsvikt.
Likende forhold berører definisjonen av septisk sjokk, som er beholdt som kategori i de reviderte definisjonene.
Budskapet som konsensusgruppen har kommet med er fanget opp i en rekke miljø nasjonalt. Det er grunn til å tro at mange enheter betrakter moderniseringen av sepsisforståelse, definisjoner og kliniske kriterier med positive øyne. Det er vår anbefaling at man i alle relevante avdelinger raskt tar stilling i dette spørsmålet og at arbeidet settes i gang med å ta i bruk nye definisjoner i revisjon/utvikling av daglige rutiner, slik vi er i gang med ved vårt sykehus. Det er imidlertid en svakhet at testene som ligger til grunn for anbefalingen er basert på retrospektive data. Man bør derfor lokalt evaluere innføring av disse endringene gjennom forskings- og utviklingsarbeid. Mens tidligere algoritmer har innbefattet oppfølging av organstatus hos pasienter med «sepsis» slik det var definert i 1992, utelukker de nye definisjonene pasienter uten organsvikt. I denne gruppen er dødeligheten lavere enn i kategoriene gitt med nye definisjoner, men det er like fullt viktig at lokale handlingsplaner inkluderer forløpsvurderinger av god kvalitet også for disse. Slike rutiner er etablert av mange og de anbefales opprettholdt som ledd i pasientsikkerhetsarbeidet vårt.
For medarbeidere i en intensivavdeling er det daglig rutine å score pasienters sykdomsgrad. Flere verktøy kan brukes til dette, men det er fullt mulig å innføre daglig SOFA-scoring i slike avdelinger, noe som enkelte norske avdelinger allerede har gjort.
For indremedisinere vil en qSOFA raskt kunne tas i bruk. Avstanden fra primærevaluering med avkrysning av tre markører på sykdom som legen får ved å stå ved pasientsengen, til å tilby en daglig full SOFA-score kan derimot bli arbeidskrevende. En løsning vil eksempelvis være å gå videre med en full SOFA-score hos de som er qSOFA-positive, spesielt utenfor intensivenheter. Scoring utføres sekvensielt og forutsetter at man ufører blodgassanalyser og måler trombocyttall, kreatinin og bilirubin. Dette er analyser som inngår i håndtering av alvorlig infeksjon. Potensielt blir antallet pasienter man identifiserer stort, men det blir trolig mindre enn ved bruk av gamle definisjoner. Dette kan bidra til mer rasjonell bruk av begrensete ressurser i overvåkning og forløpskontroll av slike pasienter. Likeledes kan bruk av qSOFA og funn av organdysfunksjon stimulere til at man leter etter utløsende infeksjon blant pasienter der det ennå ikke er påvist.
Samtidig er det både ønskelig og nødvendig at kliniske avdelinger tar ansvar for størsteparten av pasienter med alvorlig infeksjon, eller med infeksjon der det er potensiale for vesentlig forverring. Et begrenset antall indremedisinske avdelinger har allerede egne overvåkningsenheter med erfaring i behandling og overvåking av pasienter med store medisinske behov. I slike enheter er antallet av pasienter med sepsis etter ny definisjon noe større enn i tilsvarende intensivavdelinger, slik vi har vist i en prospektiv studie av sepsis oppstått utenfor sykehus, som lå til grunn for utvikling av Medisinsk avdeling sin overvåkingsenhet ved Haukeland universitetssjukehus (HUS) (7).
De nye kriteriene er støttet av en lang rekke intensiv og akuttmedisinske foreninger i hele verden, og det er sannsynlig at de kommer til å definere den nye standarden. Hvor gode de nye kriteriene egentlig er, må vi trolig vente med svar på til det foreligger prospektive studier, ikke minst med tanke på bruk av den enkle qSOFA. Dette vil føre til endrede epidemiologiske vurderinger av forekomst av sepsis. De nye kriteriene vil nok definere en langt mindre gruppe pasienter som har sepsis enn tidligere, og forekomsten vil nok ligge omtrent på den vi har hatt for ”alvorlig sepsis”, dvs for voksne > 18 år et sted rundt 1,0/1000 innbygger per år.
Til sist er revisjonen bestilt for å gi en definisjon som er lettere til bruk i epidemiologiske og kliniske behandlingsstudier. Stadig flere mennesker dør i sykehus, og den største kategorien dødsårsak synes å være alvorlig infeksjon. Omfanget av alvorlig infeksjon blant pasienter i sykehus er altfor stort til at man kan ha en avventende holdning i dette spørsmålet. Nasjonale data mangler, men dette ser en gruppe i HUS nærmere på for tiden.
Et spørsmål som melder seg er hvorledes bruken av de nye definisjonene skal iverksettes. Statens helsetilsyn har en forståelse av hvilke standarder sykehusene skal følge i sepsishåndtering. Det første av to dokumenter som legges til grunn er kapitlet om sepsis i Helsedirektoratets Nasjonal faglig retningslinje for bruk av antibiotika i sykehus (8). Det andre er kapitelet om sepsis i Norsk legemiddelhåndbok (9). Vi deltar for tiden i slik revisjonsarbeid av begge disse dokumentene, og slik revisjon kan representere en begynnelse.
Referanser