
Elisabeth Skaar
Elisabeth Skaar, spesialist i indremedisin og geriatri, ph.d kandidat ved Universitetet i Bergen og LIS i hjertesykdommer ved Haukeland universitetssjukehus
De fleste pasienter som tilbys kateter-implantert aortaklaff (Transcatheter Aortic Valve Implantation, TAVI) har høy alder og komorbiditet. Skrøpelighet(frailty) predikerer risiko for død og komplikasjoner etter TAVI, men det fanges ikke opp ved etablerte risikoskårer. Det er derfor anbefalt å vurdere grad av skrøpelighet før inngrepet. Mange TAVI pasienter vil ha begrenset levetid selv etter inngrepet, og det er derfor viktig å undersøke pasientens motivasjon og håp for behandlingen.
Aortastenose (AS) er den vanligste klaffelidelsen i Europa [1] og har økende forekomst med alderen. Omtrent 4 % i alderen 70-79 år, og 10 % i alderen 80-89 år har AS [2]. De fleste pasientene er asymptomatiske over flere år. Når symptomene melder seg, øker mortaliteten dramatisk og en antar at halvparten dør i løpet av en 2-års periode.
Standard behandling ved alvorlig, symptomatisk AS har vært åpen hjertekirurgi, men rundt 30 % av pasientene har ikke fått tilbudet på grunn av for høy operasjonsrisiko. Første Transcatheter Aortic Valve Implantation, TAVI ble gjort i 2002 [3], og fra 2008 har dette vært et tilbud i Norge. Mange TAVI pasienter er eldre med komorbiditet. PARTNER studien fra 2010 (RCT), cohort B [4]hvor en sammenlignet TAVI mot medikamentell behandling og/eller ballong-aorta-valvuloplastikk hos inoperable pasienter, fant 1-års mortalitet på 31 % i TAVI gruppen mot 51 % i den konservativt behandlede gruppen. Pasientseleksjonen, operatørene og det tekniske utstyret (inkludert selve klaffen) har blitt bedre, og tall fra det svenske TAVI-registeret fra 2008-2013 viser 1-års mortalitet mellom 11 og 19 % [5]. Gjennomsnittsalderen på pasientene er over 80 år (82 år i det svenske registeret). Det er komplikasjoner som død, hjerteinfarkt, hjerneslag, blødning, akutt nyresvikt, vaskulære komplikasjoner, ledningsforstyrrelser og arytmier knyttet til prosedyren [6]. Flere opplever akutt forvirring i forbindelse med inngrepet [7]. Utover bedret overlevelse, viser studier en signifikant forbedring av livskvalitet etter TAVI [8, 9]. Senere studier har vist at TAVI er likeverdig til kirurgi også for høyrisiko pasienter, med samme kort- og langtidsmortalitet [10, 11]. Hos pasienter med forventet levetid kortere enn 1 år, av annen grunn enn aortastenose, anbefaler man fortsatt konservativ behandling [1, 5].

Hjertegruppen, eller » the Heart team» slik den er anbefalt av den europeiske kardiologiforeningen -ESC, European Society of Cardiology.
Skrøpelighet er definert som en tilstand med reduserte fysiologiske reserver, lavere motstand mot påkjenning og økt risiko for komplikasjoner og død [12]. Det er uenighet i fagmiljøet om en skal definere skrøpelighet som rent fysisk (uønsket vekttap, selvrapportert trøtthet, langsom ganghastighet, lavt aktivitetsnivå, redusert gripestyrke [13]) eller om kognitiv funksjon, komorbiditet, selvhjulpen i dagliglivet og psykososiale faktorer skal inkluderes [14]. I den videre drøftingen er den siste definisjonen lagt til grunn fordi den er basert på en bred geriatrisk vurdering, foreslått av Lodovico Balducci, onkolog og geriater [15, 16]. Denne utvidede definisjonen av skrøpelighet predikerer postoperative komplikasjoner etter kirurgi for kolorektalkreft bedre enn den rent fysiske definisjonen [17].
En bred geriatrisk vurdering innebærer en systematisk undersøkelse av fysisk funksjon, komorbiditet, polyfarmasi, kognisjon, ernæring, sosialt nettverk, og psykisk helse. Basert på en slik bred geriatrisk vurdering, kategoriseres pasientens helse som enten robust, intermediær eller skrøpelig. Den europeiske kardiologiforeningen (ESC) anbefaler en nøye seleksjon av TAVI pasienter, bruk av validerte tester for kognisjon, fysisk funksjon og skrøpelighet [1]. Det samme anbefaler «the Valve Academic Research Consortium 2 (VARC 2)» som er et europeisk og nord- amerikansk konsensusdokument for standardiserte endepunkter etter TAVI [6]. Både ESC og VARC 2 anbefaler et bredt sammensatt hjerteteam, hvor geriater kan bidra i beslutningsprosessen før TAVI.
En systematisk gjennomgang fra 2014 konkluderte med at skrøpelighet øker risiko for komplikasjoner og død etter hjertekirurgi eller TAVI med odds ratio på 4,9 (95 % konfidensintervall 1,6-14,6) med større risiko hos eldre pasienter som gjennomgikk TAVI enn yngre som gjennomgikk åpen hjertekirurgi [18]. I de neste avsnittene går jeg nærmere inn på deler av den geriatriske vurderingen, der jeg har valgt å fokusere på kognisjon, fysisk funksjon og ernæring.
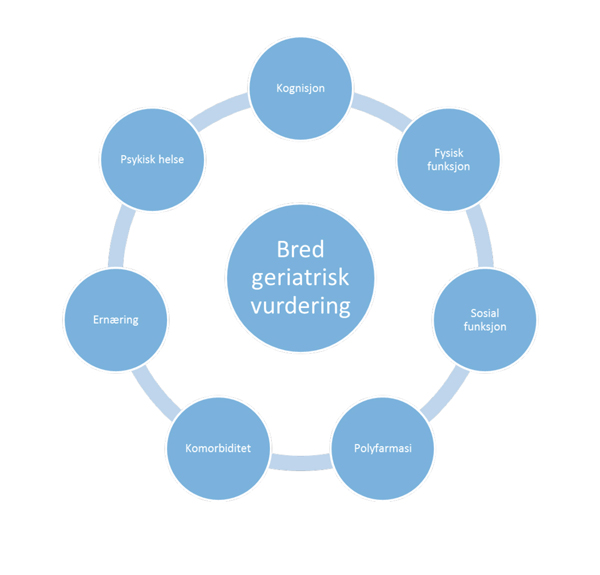
Figur 2. Skrøpelighet kan vurderes på bakgrunn av en bred geriatrisk vurdering. De ulike elementene undersøkes ved validerte spørreskjema og tester.
Forekomsten av demens øker eksponentielt med alderen: I Vest- Europa fra 1,6 % i aldersgruppen 60-64 år til 43 % i gruppen over 89 år [19], selv om nylig publiserte data viser en nedgang i aldersspesifikk insidens av demens [20]. Det er enighet i fagmiljøet om at man ikke tilbyr TAVI til pasienter med demenssykdom av alvorlig grad, mens det ikke er konsensus om pasienter med mild til moderat grad av sykdommen. Den vanligste formen for demens er Alzheimers sykdom, og endel av disse pasientene har ikke innsikt i egen kognitiv svikt [21] og beslutningskompetansen kan være redusert. Vi har lite forskning å støtte oss på når det gjelder TAVI og demens, og jeg tillater meg derfor å komme med noen synspunkter. En ønsker ikke å diskriminere pasienter med en mild grad av demens fra god symptomlindring, samtidig bør en reflektere over det etiske ved å forlenge livet hos en pasient med en alvorlig og progredierende grunnlidelse som tilslutt vil gjøre pasienten fullt pleietrengende. TAVI er dessuten et potensielt risikofylt inngrep og det er nødvendig å vurdere beslutningskompetansen til pasienten. Klokketegning [22] og Mini Mental Status Evaluering(MMSE)[23]kan brukes til å vurdere kognitiv funksjon, men det krever kompetanse (for eksempel geriater, alderspsykiater, psykolog, nevrolog) for å tolke resultatet og for å vurdere pasientens beslutningskompetanse.
Ganghastighet (på 5 meters distanse) predikerer mortalitet og morbiditet hos eldre pasienter som gjennomgår hjertekirurgi [24]. Enkelte argumenterer for å bruke ganghastighet som eneste screening for skrøpelighet hos pasienter over 70 år med AS [25]. Gripestyrke kan også brukes for å måle skrøpelighet, og kan enkelt måles med et dynamometer.
Lav kroppsmasseindeks og ufrivillig vekttap er også markører på skrøpelighet [13]. Det anbefales å gjøre screening for underernæring med for eksempel Mini Nutritional Assessment [26].
En måte å organisere dette på er beskrevet i en studie fra Sveits hvor en spesialsykepleier gjør en skrøpelighetsscreening med blant annet MMSE og måler ganghastighet [27]. Dersom det er diskrepans mellom klinisk vurdering og kognitiv testing blir pasienten vurdert av geriater. Geriaterens rolle er å gjøre en grundigere vurdering for å indentifisere pasienter hvor livskvaliteten er redusert på grunn av alvorlig aortastenose og å ekskludere pasienter som har høy risiko for å dø kort tid etter TAVI av annen sykdom. Geriateren vurderer blant annet pasientautonomi i dagliglivet, skrøpelighet og kognitiv funksjon.
Delt beslutningstaking eller samvalg [28] er anbefalt når medisinske beslutninger tas. Det begynner å komme forskning på pasientpreferanser ved TAVI. En studie viste at spørsmålet «Hva håper du å oppnå ved å få ny hjerteklaff?» var viktig for å få frem pasientperspektivet [29]. En svensk studie viste at pasientene hadde ulike mønstre i beslutningsprosessen og at de trenger forskjellig tilnærming fra helsepersonell [30].
Skrøpelighet predikerer mortalitet og morbiditet ved TAVI, men det er ikke konsensus om hvilke tester man bør bruke. En skrøpelighetsvurdering vil gi støtte til en vanskelig beslutning, på en mer objektiv måte enn «eyeballing» som brukes mye [31]. Den endelige beslutningen om å tilby behandlingen må imidlertid tas av de som utfører inngrepet. TAVI pasienter har høy alder og andre samtidige sykdommer, og pasientens motivasjon og forhåpning til effekten av prosedyren blir også viktig i beslutningsprosessen.
Forfatteren har fått støtte til forskning fra hjerteavdelingen på Haukeland Universitetssykehus, Kavli forskningssenter for geriatri og demens, Haraldsplass Diakonale Sykehus og Grieg Foundation. Ingen interessekonflikter.
Oversatte validerte geriatriske tester finnes lett tilgjengelig på Norsk geriatrisk forenings nettsider via legeforeningen.no.
Litteratur: